|
| |
Hier haben wir einige chemische Versuche aus dem Internet
zusammengetragen:
Eventuelle Urheberrechte liegen beim jeweiligen
Verfasser.
Themen�bersicht:
Chemische Reinigung
Kurzbeschreibung:
In vielen Chemischen Reinigungen wird das L�sungsmittel PER benutzt. PER ist sehr
gesundheitssch�dlich und gef�hrdet Mensch und Umwelt. PER kann aus Kleidung ausd�nsten,
aus den Reinigungsmaschinen austreten und sich in Nahrungsmitteln und im menschlichen
K�rper anreichern. Die Beseitigung von PER ist problematisch.
M�gliche Experimente:
Filterung und Recycling von chlorierten Kohlenwasserstoffen durch Aktivkohlefilter.
Alt�l und
Alt�lwiederaufarbeitung
Kurzbeschreibung:
Alt�l ist ein gef�hrlicher Abfall und gleichzeitig ein wertvoller Rohstoff. Wenn Alt�l
ins Wasser gelangt, gibt es gro�e Sch�den. Wenn es sachgerecht gesammelt wird, l��t es
sich weitgehend wieder aufarbeiten. Jedes Kraftfahrzeug produziert im Jahr einige Liter
Alt�l.
M�gliche Experimente:
Wiederaufarbeitung von Alt�l.
Klebstoffe
Kurzbeschreibung:
Klebstoffe werden in Haushalt, Handwerk und Industrie in gro�en Mengen verwendet. Viele
Klebstoffe geben dabei gef�hrliche Stoffe an die Umwelt ab. Erst in letzter Zeit finden
sich auf dem Markt harmlosere Produkte.
M�gliche Experimente:
Bestimmung der L�semittel in verschiedenen Klebstoffen durch Destillation und Analyse des
Destillats.
Klebversuche, umweltfreundliche und -feindliche Klebstoffe vergleichen.
"Uhugeruch" synthetisieren.
Einfachen Klebstoff herstellen.
Geruch von Klebstoffen vergleichen.
Farben, Lacke und Holzschutzmittel
Kurzbeschreibung:
Farben und Lacke werden in Haushalt, Handwerk und Industrie in gro�en Mengen verwendet.
Viele Farben und Lacke geben dabei gef�hrliche Stoffe an die Umwelt ab. Erst in letzter
Zeit finden sich auf dem Markt harmlosere Produkte.
Durch eigenes Verhalten kann ein gro�er Teil des Risikos vermieden werden.
M�gliche Experimente:
Bestimmung der L�semittel in verschiedenen Farben und Lacken durch Destillation und
Analyse des Destillats.
Vergleich verschiedener Lacke als Anstrich.
B�romaterialien
Kurzbeschreibung:
Viele B�romaterialien (Filzstifte, Tippex, ...) geben bei der Verwendung gef�hrliche
D�mpfe an die Umgebung ab. Aus Kunststoffen der Ger�tegeh�use verdunsten Weichmacher.
Folien und Klebeb�nder enthalten das problematische PVC, bei dessen Verbrennung Dioxin
entsteht.
M�gliche Experimente:
Filzstifte untersuchen.
Eigenschaften von Tippex-Verd�nner feststellen.
PVC nachweisen.
Formaldehyd in Wohn- und
Arbeitsr�umen
Kurzbeschreibung:
Seit einigen Jahren gibt es immer wieder Zeitungsmeldungen �ber gef�hrliches,
krebserregendes Formaldehyd in der Luft von Wohn- und Arbeitsr�umen. Vieles davon stammt
aus Spanplatten, ein gro�er Teil aber auch aus dem Zigarettenrauch.
M�gliche Experimente:
Herstellung eines Formaldehydkunststoffes.
Nachweis von Formaldehyd in Zigarettenrauch.
Nachweis von Aldehyden durch die Silberspiegelreaktion.
Benzin
Kurzbeschreibung:
Beim Tanken und aus den Benzintanks der Autos verdampft viel Benzin. Im Benzindampf sind
gesundheitsgef�hrdende Substanzen, u. a. das krebsausl�sende Benzol, enthalten, der
Benzindampf tr�gt zum Treibhauseffekt bei.
M�gliche Experimente:
Nachweis von Aromaten (Benzol) im Benzin.
Wie dicht ist ein Reservekanister?
Konzentration von Aromaten an der Tankstelle oder vielbefahrener Strasse messen.
PCP - Pentachlorphenol
Kurzbeschreibung:
PCP wird als Konservierungsmittel f�r Leder eingesetzt. Es kann aus dem Leder in die Haut
gelangen. In Deutschland ist es wegen erwiesener Krebsverursachung verboten, f�r
Importleder gelten strenge Grenzwerte. Trotzdem gelangt immer wieder PCP belastetes Leder
in den Handel.
Dieses Thema wird gerade aktuell von den Medien behandelt.
Erstmalig bekannt wurde PCP durch Vergiftungen mit Holzschutzmitteln und die langwierigen
Prozesse der Betroffenen gegen die BAYER-Chemie.
M�gliche Experimente:
Modellversuche zur Chromatographie.

Konkrete Versuche:
Trennung von L�semittelgemischen
durch Destillation
Verschiedene miteinander vermischte L�sungsmittel lassen sich durch Destillation
voneinander trennen. Eine einfache Destillationsanlage (wie beim Rotwein) kann aber nur
Substanzen mit stark unterschiedlichen Siedepunkten voneinander trennen. In dieser
Versuchsreihe wird eine bessere Destillationsanlage entwickelt.
Die Qualit�t der Destillation kann man mit einem Thermometer vor dem Eingang des
K�hlers beurteilen, wenn man in einer Kurve den Temperaturverlauf gegen die Zeit
auftr�gt. Je "stufiger" die Kurve, desto besser die Destillation.
Chemikalien und Ger�te:
L�sungsmittelgemisch (vom Lehrer
angemischt)
Schliffger�tesatz
Heizpilz
Schliffett
Millimeterpapier
Sicherheitshinweise / Entsorgung
Schutzbrille
Abf�lle beim Lehrer abgeben!
Durchf�hrung:
Die Destillationsanlage wird aufgebaut (dabei VORHER den Lehrer nach dem Umgang mit dem
Schliffger�t fragen!) und sp�ter schrittweise erweitert.
Zuerst wird eine einfache Apparatur benutzt:
Der Destillationskolben wird zu 1/3 mit dem L�sungsmittelgemisch gef�llt, drei
Siedesteinchen dazugegeben, die Anlage verschlossen, die K�hlung angestellt und die
Heizung eingeschaltet. In Minutenabst�nden wird die Temperatur abgelesen und in das
Diagramm eingetragen.
Jedesmal, wenn sich eine Stufe in der Temperaturkurve zeigt, wird an der Spinne ein
neues K�lbchen eingeschwenkt. Der Inhalt der K�lbchen wird getrennt gesammelt.
Wenn der gr��te Teil des L�sungsmittels �berdestilliert ist, wird die Heizung
abgeschaltet. ES MUSS FL�SSIGKEIT IM DESTILLATIONSKOLBEN ZUR�CKBLEIBEN!!!!
Der gleiche Versuch wird dann mit einem zwischen Kolben und Vorsto� eingebauten
Zylinder wiederholt.
Als Letztes wird der Zylinder mit Glasringen (Raschigringe) gef�llt und noch einmal destilliert.
Auswertung:
Vergleicht die Temperaturkurven und die Reinheit der einzelnen Fraktionen (Dazu Lehrer
fragen).
Theorie:
Als Beispiel dient hier ein Gemisch aus zwei verschiedenen Substanzen A und B. B hat
dabei den h�heren Siedepunkt.
Im Kolben sind 50% A und 50% B. Das Gemisch verdampft, im Dampf ist der Anteil von A
gr��er als der von B, sagen wir etwa 70% zu 30%.
Bei einer einfachen Destille gelangt dieser Dampf in den K�hler, kondensiert und l�uft
in die Vorlage. Die erste Fraktion enth�lt also noch 30% B.
Wenn man zwischen Kolben und K�hler ein Glasrohr setzt, kondensiert der Dampf schon an
der Glaswand. Hier kann das Gemisch jedoch wieder verdampfen, und jetzt ist dem Dampf der
Anteil an A wieder gr��er als in der Fl�ssigkeit (z.B. 80% A : 20% B). Je gr��er die
Oberfl�che des Rohres ist, desto �fter l�uft dieser Schritt ab und desto besser werden
die Komponenten getrennt. Durch die Raschigringe wird die Oberfl�che im Rohr stark vergr��ert.
Weitere Informationen finden sich in den Chemienachschlagewerken unter dem Stichwort
"Destillation"

Nachweis von Formaldehyd in
Filzstiften
Chemikalien und Ger�te:
fuchsinschwefelige S�ure
konz. Salzs�ure
Filzstift
Saugfinger (starkes Reagenzglas mit seitlichem Ansatz)
durchbohrter Stopfen
gewinkeltes Glasrohr
kurzes Schlauchst�ck
Wasserstrahlpumpe mit Druckschlauch
Sicherheitshinweise / Entsorgung
Schutzbrille!
Abf�lle nicht in den Ausgu�, sondern beim Lehrer abgeben!
Durchf�hrung:
Der Saugfinger wird mit etwas kaltem Wasser gef�llt und die Apparatur zusammengebaut.
Der Filzstift wird an beiden Enden ge�ffnet und und in das Schlauchende gesteckt. Mit der
Wasserstrahlpumpe wird Luft durch den Filzstift gesaugt.
Nach dem man die Wasserstrahlpumpe abgestellt hat, gibt man etwas fuchsinschwefelige
S�ure in den Saugfinger. Wenn sich Formaldehyd im Wasser gel�st hat, f�rbt sich die
L�sung nach einiger Zeit purpurrot. Die Zugabe von konz. Salzs�ure f�hrt dann zu einer
stabilen Blauf�rbung.
Auswertung:
Siehe "Nachweis von Formaldehyd".

Herstellung von Indikatorpapier
zum Nachweis von Formaldehyd in der Luft
Chemikalien und Ger�te:
Filterpapier
Fuchsinschwefelige S�ure
Tropfpipette
gro�es Uhrglas
Schere
Schnappdeckelgl�ser oder Marmeladengl�ser
Sicherheitshinweise / Entsorgung
Handschuhe, Schutzbrille!
Durchf�hrung:
W�hrend der Herstellung des Indikatorpapieres darf nicht mit Formaldehyd gearbeitet
werden, weil sich sonst das Papier gleich verf�rbt.
Mit der Tropfpipette gibt man soviel Fuchsinschwefelige S�ure auf das Filerpapier,
da� es gut angefeuchtet ist, l��t ein wenig antrocknen und tropft nochmals auf. Nachdem
das Papier getrocknet ist, wird es in Streifen zerschnitten und einzel luftdicht in den
Gl�sern untergebracht.
Auswertung:
Siehe "Nachweis von Formaldehyd in der Luft"

Nachweis von Formaldehyd in
Zigarettenrauch
Chemikalien und Ger�te:
fuchsinschwefelige S�ure
konz. Salzs�ure
Zigarette
Saugfinger (starkes Reagenzglas mit seitlichem Ansatz)
durchbohrter Stopfen
gewinkeltes Glasrohr
kurzes Schlauchst�ck
Wasserstrahlpumpe mit Druckschlauch
Sicherheitshinweise / Entsorgung
Schutzbrille!
Abf�lle nicht in den Ausgu�, sondern beim Lehrer abgeben!
Durchf�hrung:
Der Saugfinger wird mit etwas kaltem Wasser gef�llt und die Apparatur entsprechend der
Abb. zusammengebaut. Die Zigarette wird angez�ndet, in das Schlauchende gesteckt und der
Rauch mit der Wasserstrahlpumpe durch das Wasser gesaugt. (Bitte nicht den Schlauch
ansengen.)
Nach dem Abbrennen der Zigarette gibt man etwas fuchsinschwefelige S�ure in den
Saugfinger. Wenn sich Formaldehyd im Wasser gel�st hat, f�rbt sich die L�sung nach
einiger Zeit purpurrot. Die Zugabe von konz. Salzs�ure f�hrt dann zu einer stabilen
Blauf�rbung.
Auswertung:
Siehe "Nachweis von Formaldehyd".

L�sungsmittel aus Klebstoff oder
Lack herausdestillieren
Chemikalien und Ger�te:
1 gro�es Reagenzglas
1 Reagenzglas
1 durchbohrter Stopfen
1 2-fach gewinkeltes Glasrohr
1 Becherglas
1 Tempotaschentuch
Eis
Klebstoff oder Lack
Sicherheitshinweise / Entsorgung
Im Abzug oder am offenen Fenster arbeiten
Destillat nicht in den Abflu�! Auf Halogene untersuchen und entsprechend entsorgen.
Durchf�hrung:
Enstprechend der Abbildung wird eine einfache Destillationsapparatur aufgebaut. (Man
benutzt hier keine "richtige" Destille, weil die Reste des Lackes/Klebstoffes
nur sehr schwer aus dem Gef�� zu entfernen sind.)
Der Klebstoff oder Lack wird in das gro�e Reagenzglas gef�llt, das Tempotaschentuch
als K�hlung mit kaltem Wasser angefeuchtet und die Vorlage mit Eis gek�hlt.
Der Inhalt des gro�en Reagenzglases wird nun von oben beginnend mit der
Bunsenbrennerflamme vorsichtig erhitzt. (Wenn mann unten anf�ngt, gibt es gro�e Blasen.)
Klebstoff kann man auch zuerst im Wasserbad erhitzen.

Nachweis von Alkoholen
Chemikalien und Ger�te:
Cerammoniumnitrat-Reagenz
Dioxan
Reagenzgl�ser
Pipetten
Pelleusball (Pipettierhilfe)
Sicherheitshinweise / Entsorgung
Die Fl�ssigkeiten nicht mit dem Mund in die Pipette saugen, dazu den Pelleusball
benutzen. (Hilfe vom Lehrer )
Schutzbrille! Handschuhe!
Abf�lle nicht in den Ausgu�, beim Lehrer abgeben!
Durchf�hrung:
1 ml Cerammoniumnitrat-Reagenz werden mit 6 ml Dioxan und anschlie�end soviel Wasser
versetzt, da� eine klare L�sung entsteht. Dazu wird eine Mischung aus 1 ml Probe
und 1 ml Dioxan gegeben.
Auswertung:
Alkohole und Phenole ergeben eine Rotf�rbung.

Nachweis von Aromaten
Chemikalien und Ger�te:
Aluminiumchlorid, wasserfrei
Trichlormethan ( = Chloroform)
Reagenzgl�ser
Sicherheitshinweise / Entsorgung
Im Abzug arbeiten, Schutzbrille und Schutzhandschuhe benutzen.
L�semittelabf�lle ins Sammelgef�� "Chlorhaltige Kohlenwasserstoffe"!
Das Reagenzglas mit dem Aluminiumchlorid im Abzug vorsichtig mit Wasser f�llen. Dabei
entsteht �tzendes Chlorwasserstoffgas (HCl)! Dann in den Abflu� im Abzug kippen und
Wasser nachlaufen lassen.
Durchf�hrung:
In einem Reagenzglas wird eine Spatelspitze Aluminumchlorid �ber dem Bunsenbrenner
erhitzt. Das Aluminiumchlorid sublimiert und schl�gt sich als gelber Ring an der kalten
Glaswand nieder.
In einem zweiten Reagenzglas werden gleiche (kleine) Mengen des zu pr�fenden
L�semittels mit Trichlormethan gemischt. Einige Tropfen der Mischung werden dann
vorsichtig auf den gelben Ring getropft.
Auswertung:
Eine Verf�rbung zeigt die Anwesenheit von aromatischen Verbindungen an. Die Farbe
h�ngt von der Art des Aromaten ab.
Theorie:
Aromatische Verbindungen reagieren mit Trichlormethan zu Triphenylmethan-Farbstoffen.
Dabei wirkt Aluminiumchlorid als Katalysator.

Nachweis von Carbons�ureestern
Chemikalien und Ger�te:
Methanol
methanolische Natronlauge (NaOH in CH3OH gel�st)
Phenolphtaleinl�sung
Reagenzgl�ser
Tropfpipette
Becherglas
Heizplatte (keinen Bunsenbrenner!)
Sicherheitshinweise / Entsorgung
Schutzbrille tragen!
Im Abzug arbeiten!
Abf�lle nicht in den Ausgu�, beim Lehrer abgeben!
Durchf�hrung:
1 ml der Probe und 3 ml Methanol werden zusammen mit einigen Tropfen
Phenolphtaleinl�sung in ein Reagenzglas gegeben. Dann wird solange methanolische
Natronlauge zugetropft, bis sich eine leichte Rotf�rbung zeigt.
Das Reagenzglas wird f�r 5 - 10 Minuten in das Becherglas mit warmen Wasser gestellt.
Auswertung:
Wenn die Rotf�rbung verschwunden ist, sind Carbons�ureester im L�sungsmittel
enthalten.
Theorie:
Phenolphtalein ist ein Indikator f�r Basen. Daher f�rbt sich das Gemisch nach der
Zugabe von methanolischer Natronlauge rot.
Ester sind Verbindungen zwischen einer organischen S�ure und einem Alkohol. In der W�rme
kann diese Verbindung wieder gespalten werden. Die freiwerdende S�ure neutralisiert die
Natronlauge, die L�sung ist nicht mehr basisch, die rote Farbe verschwindet.

Nachweis von Formaldehyd mit
Fuchsinschwefeliger S�ure
Chemikalien und Ger�te:
Reagenzgl�ser
Fuchsinschwefelige S�ure
konz. Salzs�ure
Formaldehydl�sung, max. 25%
Sicherheitshinweise / Entsorgung
Schutzbrille, Handschuhe, Abzug
Reste nicht in den Ausgu�, sondern beim Lehrer abgeben.
Durchf�hrung:
Zu etwas Formaldehydl�sung wird Fuchsinschwefelige S�ure gegeben. Es bildet sich eine
rote F�rbung.
Wenn man etwas konz. Salzs�ure zusetzt, bildet sich eine �ber l�ngere Zeit stabile
Blauf�rbung aus.
Auswertung:
Fuchsinschwefelige S�ure ist eine farblose Verbindung aus dem roten Farbstoff Fuchsin
und dem Sulfition SO3-.
Das Formaldehyd spaltet das Sulfition aus der Verbindung ab, es bleibt der rote Farbstoff
zur�ck. Der genaue Mechanismus ist nicht bekannt.

Nachweis von
Halogenkohlenwasserstoffen
(Beilsteinprobe)
Chemikalien und Ger�te:
Kupferblech oder Pfennig
Tiegelzange
Bunsenbrenner
Sicherheitshinweise / Entsorgung
Schutzbrille! Nur kleine Mengen verwenden! Abzug!
Durchf�hrung:
Das Kupferblech wird in der Flamme gr�ndlich ausgegl�ht. Die Flamme darf sich nicht
mehr gr�n f�rben.
Ein Tropfen der Probe wird auf das hei�e Kupferblech getropft. Das Blech wird dann
wieder in der Flamme ausgegl�ht.
Auswertung:
Wenn sich die Flamme gr�n f�rbt, sind in dem L�sungsmittel
Halogenkohlenwasserstoffen enthalten.
Theorie:
Die Elemente Fluor, Chlor, Brom und Iod werden Halogene genannt. In
Halogenkohlenwasserstoffen sind einige Wasserstoffatome durch Halogenatome ersetzt. Diese
Halogen verbinden sich mit dem hei�en Kupfer zu z. B. Kupferchlorid. Diese Verbindungen
verdampfen leicht und f�rben die Flamme gr�n.

Sauerstoffnachweis in L�semitteln
Chemikalien und Ger�te:
Magnesiumsp�ne
Sand
Reagenzglas
Durchbohrter Stopfen
gewinkeltes Glasrohr
Stativ
Sicherheitshinweise / Entsorgung
Schutzbrille! Im Abzug arbeiten!
Der Versuch darf nicht mit halogenhaltigen L�semitteln durchgef�hrt werden. daher
vorher die Beilsteinprobe durchf�hren!
Abf�lle nicht in den Ausgu�, sondern beim Lehrer abgeben!
Durchf�hrung:
Gie�e in ein Reagenzglas etwa 1 cm hoch der Fl�ssigkeit und gib etwa 3 cm hoch
trockenen Sand dazu. Der Sand sollte feucht aber nicht na� sein.
Spanne das Reagenzglas an der M�ndung waagerecht in ein Stativ ein und gib zwei Spatel
Magnesiumsp�ne in die Mitte des Reagenzglases. Verschlie�e das Reagenzglas mit einem
durchbohrten Stopfen, in dem eine gewinkelte Glasspitze steckt.
Mit der rauschenden Bunsenbrennerflamme wird kurz der Sand erw�rmt, anschlie�end die Magnesiumsp�ne kr�ftig erhitzt.
Der aus der Glasspitze austretende Dampf wird angez�ndet.
Sobald das Magnesium zu gl�hen anf�ngt, wird nur noch der Sand vorsichtig erw�rmt. Die
Flamme sollte nicht gr��er als 5 cm werden.
Auswertung:
Wenn sich Magnesiumoxid bildet, ist Sauerstoff in der Verbindung enthalten.

Nachweis von Formaldehyd in der
Luft
Chemikalien und Ger�te:
Glas mit Indikatorpapier
(Herstellung s. andere Anleitung)
Sicherheitshinweise / Entsorgung
Indikatorpapier nicht anfassen, nach Gebrauch in anderes Papier wickeln und in den
Papierkorb geben.
Durchf�hrung:
Im zu untersuchenden Raum wird der Deckel vom Gef�� entfernt und das Papier mit
einigen Tropen Wasser angefeuchtet.
Auswertung:
Wenn sich das Papier innerhalb von 30 Minuten r�tlich f�rbt, ist Formaldehyd in der
Luft enthalten. Nach dieser Zeit kann die F�rbung auch durch Luftsauerstoff hervorgerufen
werden.

PVC identifizieren
( Beilsteinprobe )
Chemikalien und Ger�te:
Kupferblech oder Pfennig
Tiegelzange
Bunsenbrenner
Sicherheitshinweise / Entsorgung
Schutzbrille! Nur kleine Mengen verwenden! Abzug!
Durchf�hrung:
Das Kupferblech wird in der Flamme gr�ndlich ausgegl�ht. Die Flamme darf sich nicht
mehr gr�n f�rben.
Etwas Kunststoff wird auf dem hei�en Kupferblech geschmolzen (Nase weg! Gef�hrliche
D�mpfe!). Das Blech wird dann wieder in der Flamme ausgegl�ht.
Auswertung:
Wenn sich die Flamme gr�n f�rbt, handelt es sich bei dem Kunststoff um PVC.
Theorie:
In PVC sind gro�e Mengen Cjlor enthalten. Das Clor verbindet sich mit dem hei�en
Kupfer zu Kupferchlorid. Diese Verbindung verdampft leicht und f�rbt die Flamme gr�n.

Ausarbeitung zum Thema
Tritium
Radiologische Auswirkungen eines Fusionsreaktors auf die Umwelt
Inhaltsverzeichnis
Kurze Einf�hrung
zur Fusion
Vorkommen von Tritium (Nat�rliches Vorkommen und k�nstliche
Darstellung)
HT und HTO, Formen des Tritium und biologische Wirksamkeit
Normalbetrieb des Reaktors
St�rfall - Ein Rechenmodell
Abschlie�ende Betrachtungen
Kurze
Einf�hrung zur Fusion
Obwohl die
wirtschaftliche Nutzung eines Fusionsreaktors erst in einiger Zukunft zu erwarten ist,
steht doch mit ziemlicher Sicherheit fest, da� die verwendete Fusionsreaktion die
Verschmelzung von Deuterium und Tritium sein wird. Bei dieser Reaktion kann die gr��te
Energieausbeute bei niedrigster Plasmatemperatur und gr��tem Wirkungsquerschnitt erzielt
werden; das bedeutet, da� diese Reaktion technisch am einfachsten zu realisieren sein
d�rfte.
Es gibt dabei allerdings einen gro�en Nachteil, der in den Reaktanden
selbst begr�ndet liegt: Tritium ist radioaktiv. Deswegen gibt es bereits heute einige
Studien und Rechenmodelle, die sich mit der Strahlenbelastung beim Normalbetrieb bzw. bei
einem St�rfall des Reaktors besch�ftigen. Dazu sp�ter mehr.
Vorkommen von Tritium
(Nat�rliches Vorkommen und k�nstliche Darstellung)
Im normalen
Alltag stellt Tritium keine Belastung dar, da es in der Natur nur in winzigen Mengen
vorkommt (nur eines von 1018 Wasserstoffatomen ist ein Tritiumatom)
Nat�rliches Tritium wird in der Natur in der oberen Atmosph�re
gebildet durch Neutronen, die aus dem Weltraum einfallen; sie reagieren dabei mit dem
Stickstoff der Luft:
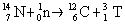
Das Tritium hat eine Halbwertszeit von 12,35 Jahren und zerf�llt als
niederenergetischer �- Strahler in Helium (He-3)
Tritium kommt in der Natur (im Gegensatz zum Deuterium) nicht in Mengen
vor, die gro� genug w�ren, um als Rohstoffgrundlage f�r die Versorgung eines Reaktors
zu dienen. Daher wird Tritium k�nstlich hergestellt. Das geschieht bereits heute
(gr��tenteils als Grundlage f�r Wasserstoffbomben) in Spaltungsreaktoren. Man nutzt
dabei die thermischen Neutronen, die in solchen Reaktoren frei werden. Diese werden auf
Lithium-Kapseln geschossen, wo sie nach folgender Reaktion Tritium bilden: 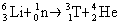
Anmerkung: eine �hnliche Reaktion ist auch mit Li-7 m�glich, nur
m�ssen hier Neutronen mit h�herer Energie verwendet werden.
Die selbe Reaktion wird man auch im Fusionsreaktor nutzen k�nnen, denn
bei der Fusion von Deuterium mit Tritium werden ebenfalls Neutronen freigesetzt. Man
ordnet dazu um das Plasma herum einen sogenannten Brutmantel an, der Lithium enth�lt.
Man nimmt heute an, das ein Reaktor mit 6 GW thermischer Leistung etwa
35 g Tritium pro Stunde umsetzen wird (das sind gut 100 kg im Jahr), und durch die
Erbr�tung des Tritiums im Brutmantel wird sichergestellt, da� st�ndig einige Kilogramm
Tritium in der Reaktoranlage vorhanden sein werden. Die Annahmen �ber die Verteilung des
Tritiums auf die verschiedenen Teile der Reaktoranlage sind heute noch sehr unsicher, aber
es werden st�ndig wohl zwischen 3 und 5 kg st�ndig vorhanden sein. Hier eine
Absch�tzung �ber die Verteilung:
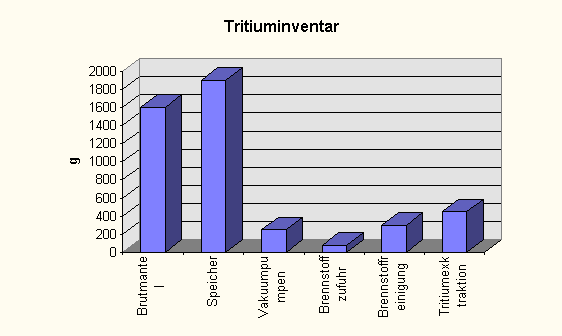
Tritiuminventar eines
1 GW (thermisch) Reaktors
|
|
10e4 TBq
|
g
|
Brutmantel
|
57
|
1600
|
Speicher
|
68
|
1900
|
Vakuumpumpen
|
8,9
|
250
|
Brennstoffzufuhr
|
2,9
|
80
|
Brennstoffreinigung
|
11
|
300
|
Tritiumexktraktion
|
16
|
450
|
Summe
|
163,8
|
4580
|
Dazu eine Graphik:
HT und HTO, Formen des Tritium und biologische Wirksamkeit
Fragt man nach
der biologischen Wirksamkeit des Tritiums, so mu� man wissen, da� es eine wesentliche
Rolle spielt, in welcher chemischen Form das Tritium freigesetzt wird.
Es gibt zwei Formen die in diesem Zusammenhang wichtig sind:
Gasf�rmige Form (reduzierte Form, d.h. Oxidationsstufe
0): HT, DT und T2
Tritiertes Wasser (oxidierte Form, d.h.
Oxidationsstufe -1): HTO, DTO und T2O
Zwei Unf�lle in einer Nuklearanlage in Savannah River (USA) haben
gezeigt, das die oxidierte Form um etwa einen Faktor 25.000 toxischer ist als die
reduzierte Form.
Daf�r gibt es im wesentlichen zwei Gr�nde:
HT DT T2 werden zwar mit der Atemluft eingeatmet, aber in
der Lunge nicht weiter umgesetzt. Der gr��te Teil wird einfach wieder ausgeatmet.
Da der menschliche K�rper zu einem gro�en Anteil aus Wasser besteht,
ist die Durchl�ssigkeit f�r HTO weitaus gr��er. Die Atemwege (Schleimh�ute) sind
feucht, das HTO der Luftfeuchte vermischt sich mit dem K�rperwasser, denn die oxidierte
Form verh�lt sich chemisch exakt wie normales Wasser und nimmt daher an allen Umsetzungen
im K�rper, ebenso wie in der Atmosph�re und dem Boden, teil.
Wie bereits erw�hnt wurde, ist Tritium ein niederenergetischer �-
Strahler. Da die Reichweite in Luft sehr begrenzt ist - im Gegensatz zu Gammastrahlung -
ist f�r die Absch�tzung der biologischen Sch�digung nur die interne Exposition
wichtig, d.h. das Tritium, das in den K�rper hinein gelangt. Je gr��er dabei die
Strahlenintensit�t ist, desto gr��er ist das Krebsrisiko, da die �-Teilchen
(Elektronen), das Zellmaterial in ihrer Umgebung statistisch sch�digen. Dies reicht von
Zellzerst�rungen bis hin zu Ver�nderungen an der DNA (Erbgut). Wird dabei zuf�llig das
Gen zerst�rt, das das Zellwachstum hemmt, kommt es zum Krebs. Dazu einige Werte, die die
Strahlenbelastung verdeutlichen sollen:
nat�rliche
Strahlenbelastung |
0,001
Sv / a |
H�chstgrenze
Strahlenschutzverordnung (f�r Personen,
die berufsm��ig mit Strahlen konfrontiert sind) |
0,050
Sv / a |
Gef�hrdungsdosis |
0,250
Sv |
geringe
Sch�den, „R�ntgenkater" |
0,500
Sv |
kritische
subletale Dosis |
1
Sv |
zu
0,5 % t�dlich |
1,25
Sv |
zu
50 % t�dlich |
4
Sv |
zu
100 % t�dlich |
>
5 Sv |
Diese �quivalenzdosis
berechnet sich nach 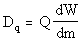 , dabei ist Q der RBW-Faktor (=Relative
biologische Wirksamkeit), der f�r �-Strahlung einen Wert von 1 hat (zum Vergleich Q(a )=20) dW/dm ist die absorbierte Energie je Masse. , dabei ist Q der RBW-Faktor (=Relative
biologische Wirksamkeit), der f�r �-Strahlung einen Wert von 1 hat (zum Vergleich Q(a )=20) dW/dm ist die absorbierte Energie je Masse.
Die Wege, wie das Tritium in den K�rper gelangen kann, sind folgende:
�ber die Atemluft
�ber die Haut
�ber die Nahrung
und �ber das Trinkwasser
Bei der Aufnahme mit der Atemluft ist die Tritiumkonzentration in der
Atmosph�re entscheidend, bei der Aufnahme mit der Nahrung mu� man dagegen wissen, wie
das Tritium in der Natur umgesetzt wird.
Zum ersten nimmt eine Pflanze HTO mit der Luftfeuchte �ber die
Bl�tter auf, entscheidender ist aber die Aufnahme aus dem Bodenwasser. Das Tritium liegt
in der Pflanze gr��tenteils als freies Wasser vor, nur ein geringer Teil wird in die
organische Struktur integriert. Dieses integrierte Tritium nennt man auch OBT (=
„organic bound tritium"). Handelt es sich bei der Pflanze um eine Futterpflanze,
so wird das Tritium in den K�rper des Tieres aufgenommen. Allerdings werden nur etwa 10%
des OBT zur Synthese tierischen Gewebes verwendet. Der Rest wird wieder mit dem
Stoffwechsel ausgeschieden. In der Milch bzw. im Fleisch des Tieres stellt sich somit im
Laufe der Zeit ein H/T-Verh�ltnis ein, wie es auch im Futter und im Trinkwasser vorliegt.
Wenn OBT mit der Nahrung bzw. HTO mit dem Trinkwasser vom Menschen
aufgenommen, so wird das Radionuklid fast vollst�ndig vom Magen-Darm-Trakt in das Blut
aufgenommen. Danach vermischt es sich mit dem K�rperwasser und unterliegt somit auch
allen biochemischen Umsetzungen, denen normales Wasser auch unterliegt. Ein kleiner Teil
des HTO wird auch vom Menschen in seine organische Struktur integriert (OBT beim
Menschen).
F�r die Verweildauer im menschlichen K�rper ergibt sich nach
Berechnungen eine Halbwertszeit zwischen 4 und 20 Tagen, im Mittel etwa 10; beim Kleinkind
liegt diese bei 3. F�r das OBT ist diese Zeit nat�rlich gr��er, da es
„tiefer" in die Struktur des Menschen eingebaut wurde. Hier ergibt sich eine
Halbwertszeit von einigen Tagen bis zu wenigen Monaten, im Mittel etwa 40 Tage; beim
Kleinkind etwa 10 Tage.
Es wird angenommen, das die Tritiumkonzentration im K�rper nirgendwo
gr��er sein kann als in den zugef�hrten Nahrungsmitteln. Da sich HTO wie normales
Wasser verh�lt, ist diese Annahme hier gerechtfertigt.
Anmerkung: Vorsicht! Dies ist nicht bei allen Isotopen
so. Beispielsweise reichert sich ein Jodisotop in bestimmten K�rperteilen an. Dies kann
in der Medizin verwendet werden, um die Funktion einiger Organe zu kontrollieren.
Normalbetrieb des Reaktors
Im folgenden
m�chte ich auf den Normalbetrieb eines Fusionsreaktors eingehen.
Bei den Absch�tzungen �ber die radiologische Belastung beim
Normalbetrieb wird angenommen, da� alles Tritium in Form von HTO freigesetzt wird.
Aufgrund des schon gesagten ist dies eine Annahme zur vorsichtigen Seite hin.
Obwohl es noch keine detaillierte Planung gibt, legt man eine Emission
von 7,5 * 1014 Bq/a als Dosisleistung fest, die �ber das ganze Jahr
gleichm��ig verteilt freigesetzt werden soll. Dies entspricht einer Menge von 2 Gramm.
Wegen der als gleichm��ig angenommen Emission kann man annehmen, da� sich im Laufe der
Zeit ein konstantes Wasserstoff/Tritium Verh�ltnis in der Natur einstellen wird.
Zur Absch�tzung der Sch�digung verwendet man ein Modell, das in der
Strahlenschutzverordnung beschrieben wird: Man geht hier von einer Anlage aus, die �ber
einen 100 m hohen Kamin emittiert, und die Anlage soll von einem Zaun umgeben sein, der
500 m, 1000 m bzw. 2000 m vom Kamin entfernt ist. Es wird nun die Strahlenexposition auf
eine Person berechnet, die sich st�ndig am Anlagenzaun aufh�lt und auch ihre gesamte
Nahrung von dort bezieht. Da f�r die Belastung der Nahrung die Belastung der Pflanzen
eine gro�e Rolle spielt, zuerst etwas dazu:
Bei der Berechnung der Aktivit�t in den Pflanzen geht man davon aus,
da� Tritium im gleichen Verh�ltnis zu Wasserstoff aufgenommen wird (bzw. HTO / H2O),
wie es in der Luft bzw. im Bodenwasser vorliegt. Man setzt an, da� 30% des HTO �ber die
Luftfeuchte und 70% �ber die Wurzeln aus dem Bodenwasser aufgenommen werden.
Bei der Berechnung der Aktivit�t in der Nahrung, d.h. Milch und
Fleisch eines Tieres, welches diese kontaminierten Pflanzen fri�t, wird eine Futtermenge
von 65 kg Pflanzenmasse je Tag angesetzt. Beim Menschen setzt man vorsichtigerweise an,
da� der Erwachsene 500 kg pflanzliche Produkte, 330 kg Milch und 150 kg Fleisch (das sind
fast 500 g Fleisch pro Tag, zum Vergleich ein dickes Steak hat maximal 400 g, ein Kotelett
ca. 200g). Beim Kleinkind setzt man 60 kg pflanzliche Produkte, 200 kg Milch und 20 kg
Fleisch an.
Aus diesen Werten erh�lt man folgende Werte im Abh�ngigkeit vom
Zaunabstand: effektive �quivalenzdosisleistung in �Sv/a
Zaunabstand |
Erwachsener |
Kleinkind |
x
= 1000 m |
|
|
Ingestion |
7 |
9 |
Inhalation |
0,5 |
0,5 |
Hautaufnahme |
0,3 |
1 |
Gesamtdosis |
8 |
11 |
x
= 500 m |
|
|
Gesamtdosis |
12 |
16 |
x
= 2000 m |
|
|
Gesamtdosis |
4 |
6 |
St�rfall - Ein Rechenmodell
Bei der
St�rfall Berechnung geht man davon aus, da� kurzfristig etwa 10 Gramm Tritium
freigesetzt werden. Man verwendet hier ein Rechenmodell, da� die Anlagengeometrie und die
klimatischen Verh�ltnisse ber�cksichtigt. Aus diesem Modell erh�lt man die
Tritiumkonzentration in der Luft am Anlagenzaun zu
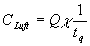
wobei Q die emittierte Aktivit�t darstellt, c
ein Kurzzeitausbreitungsfaktor, in den �berwiegend klimatische Faktoren eingehen, und tq
die Emissionsdauer darstellt.
Weiterhin ergibt sich die deponierte Tritiumaktivit�t, die durch Luft-
und Bodenfeuchte verursacht wird zu
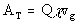
wobei vg die Ausbreitungsgeschwindigkeit darstellt. Und
schlie�lich die durch den Niederschlag deponierte Tritiumaktivit�t
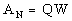
mit W als „Washout"-Faktor, in den wiederum klimatische
Gegebenheiten wie Windrichtung und Regenwahrscheinlichkeit eingehen.
Man nimmt weiter an, da� das �ber die Luftfeuchte und Niederschlag
deponierte Tritium sich mit dem Bodenwasser vermischt und somit den Pflanzen zur
Verf�gung steht. Durch den Wasserumsatz im Boden nimmt die Tritiumkonzentration im Boden
wieder ab. Man setzt hierf�r eine Halbwertszeit von etwa 7 Tagen an. Damit ergibt sich
f�r die Tritiumkonzentration im Bodenwasser:
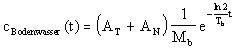
Wie schon vorher beschrieben, soll ein Anteil des Tritiums von den
Pflanzen �ber die Luft (etwa 30%) und ein Teil �ber das Bodenwasser (etwa 70%)
aufgenommen werden. Diese Anteile hei�en fL und fB. W�hrend der
Freisetzung nimmt die Tritiumkonzentration in der Pflanze der der Luftfeuchte. Ist die
Wolke (der Tritiumtransporter) erst einmal vorbeigezogen, erfolgt eine exponentielle
Abnahme mit einer schnellen und einer langsamen Komponente:
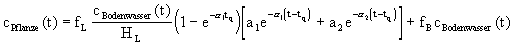
Dabei sind und Konstanten, die die Geschwindigkeit des Austausches
beschreiben und a1 und a1 stellen ihre Anteile dar, wobei sich a1=99% und a2=1% ergibt. Hl
ist hier die mittlere relative Luftfeuchte (Hl=9g/m^3)
Nun kann man den Transfer zum Menschen betrachten. Der Transfer �ber
das Fleisch spielt aber nur eine untergeordnete Rolle. Wichtiger ist der Transfer �ber
die Milch. Man setzt dabei an, das die Konzentration in der Milch proportional zu der in
der Pflanze ist.
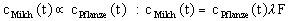
mit l als Transferfaktor und F als
Futtermenge je Tag (65 kg / Tag f�r eine Kuh)
Die Dosis, die der Mensch durch die Ingestion der Nahrung erh�lt,
berechnet sich zu:

wobei Vp und Vm die Verzehrmengen von
pflanzlichen Produkten bzw. Milchprodukten sind. g ist ein Dosisfaktor, der
ber�cksichtigt, ob die Person z.B. ein Kind oder ein Erwachsener ist.
 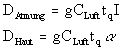
mit I als Inhalationsrate (2,3*10-4 m3/s) und a als Aufnahmerate der Haut (0,01 m3/min).
Daraus ergeben sich folgende Dosen:
Zaunabstand
x |
Erwachsener |
Kleinkind |
x
= 1000 m |
|
|
Ingestion |
23 |
32 |
Inhalation |
1 |
1 |
Hautaufnahme |
1 |
3 |
Gesamtdosis |
25 |
36 |
x
= 500 m |
|
|
Gesamtdosis |
43 |
62 |
x
= 2000 m |
|
|
Gesamtdosis |
13 |
19 |
Nun mu� man sich nat�rlich noch die Frage stellen, was von diesen
Werten �berhaupt zu halten ist.
Die Werte f�r den Normalbetrieb liegen in der Gr��enordnung von etwa
10 �Sv je Jahr, wenn man sich st�ndig am Anlagenzaun aufh�lt und auch seine gesamte
Nahrung von dort bezieht. Dieser Wert liegt in der gleichen Gr��enordnung wie bei einem
Spaltungsreaktor oder auch bei einem gro�en Kohlekraftwerk, da� einfach nat�rliche
Radionuklid freisetzt, und liegt weit unter dem zul�ssigen Grenzwert von 300 �Sv je
Jahr.
F�r die Gr��e der Tritiumkonzentration bei einem Unfall existieren
bisher nur grobe Annahmen (hier ein Rechenbeispiel mit 10 g Tritium). Es sind aber
zwischen 3 und 5 Kilogramm in der Anlage vorhanden, allerdings zum allergr��ten Teil in
nicht fl�chtiger Form. Die Dosen liegen im Bereich bis 62 mSv, wobei die gr��te
Belastung durch kontaminierte Nahrung verursacht wird. Der Grenzwert liegt hier bei 50
mSv. Es mu� also erst noch sichergestellt werden, da� die Menge emittiertes Tritium so
begrenzt wird, da� dieser Wert nicht �berschritten wird.

 
|